服务支持
渗透压摩尔浓度测定法
2016-06-23
生物膜,例如人体的细胞膜或毛细血管壁,一般具有半透膜的性质,溶剂通过半透膜由低浓度溶液向高浓度溶液扩散的现象称为渗透,阻止渗透所需施加的压力,即为渗透压。在涉及溶质的扩散或通过生物膜的液体转运各种生物过程中,渗透压都起着及其重要的作用。因此,在制备注射剂、滴眼剂等药物制剂时,必须关注其渗透压。凡处方中添加了渗透压调节剂的制剂,均应控制其渗透压摩尔浓度。例如,注射剂、滴眼剂等制剂处方中的氯化钠,其作用若主要为调节制剂的渗透压,则应作渗透压摩尔浓度检查,而无须进行氯化钠的定量测定。
静脉输液、营养液、电解质或渗透利尿药(如甘露醇注射液)等制剂,应在标签上标明其渗透压摩尔浓度,以便临床医生根据实际需要对所用制剂进行适当的处置(如稀释)。正常人体血液的渗透压摩尔浓度范围为285~310mOsmol/kg,0.9%氯化钠溶液或5%葡糖糖溶液的渗透压摩尔浓度与人体血液相当。
溶液的渗透压,依赖于溶液中粒子的数量,是溶液的依数性之一,通常以渗透压摩尔浓度(Osmolality)来表示,它反映的是溶液中各种溶质对溶液渗透压贡献的总和。渗透压摩尔浓度的单位,通常以每千克溶剂中溶质的毫渗透压摩尔来表示,可按下列公式计算毫渗透压摩尔浓度(mOsmol/kg):
毫渗透压摩尔浓度(mOsmol/kg )= 〔每千克溶剂中溶解溶质的克数/分子量〕×n ×1000
式中,n 为一个溶质分子溶解并解离时形成的粒子数。在理想溶液中,例如:葡萄糖n=1,氯化钠或硫酸镁n=2,氯化钙n=3,枸橼酸钠n=4 。
在生理范围及稀溶液中,其渗透压摩尔浓度与理想状态下的计算值偏差较小;随着溶液浓度的增加,与计算值比较,实际渗透压摩尔浓度下降。例如0.9%氯化钠注射液,按上式计算,毫渗透压摩尔浓度是2×1000×9/58.4=308mOsmol/kg,而实际上在此浓度时氯化钠溶液的n稍小于2,其实际测得值是 286mOsmol/kg;复杂混合物,如水解蛋白注射液的理论渗透压摩尔浓度不容易计算,因此通常采用实际测定值表示。
1 渗透压摩尔浓度的测定
1.1 原理 通常采用测量溶液的冰点下降来间接测定其渗透压摩尔浓度。在理想的稀溶液中,冰点下降符合ΔTf =Kf·m 的关系,式中,ΔTf为冰点下降的,Kf为冰点下降常数(当水为溶剂时为 1.86),m 为重量摩尔浓度。而渗透压符合Po=Ko ·m 的关系,式中,Po 为渗透压,Ko 为渗透压常数,m 为溶液的重量摩尔浓度。由于两式中的浓度等同,故可以用冰点下降法测定溶液的渗透压摩尔浓度。
1.2 仪器 常用的渗透压摩尔浓度测定仪通常是采用冰点下降的原理设计的。渗透压摩尔浓度测定仪由制冷系统、用来测定电流或电位差的热敏探头和振荡器(或金属探针)组成。测定时将测定探头浸入供试溶液的中心,并降至仪器的冷却槽中。启动制冷系统,当供试溶液的温度降至凝固点以下时,仪器采用振荡器(或金属探针)诱导溶液结冰,自动记录冰点下降的温度。仪器显示的测定值可以是冰点下降的温度,也可以是渗透压摩尔浓度。
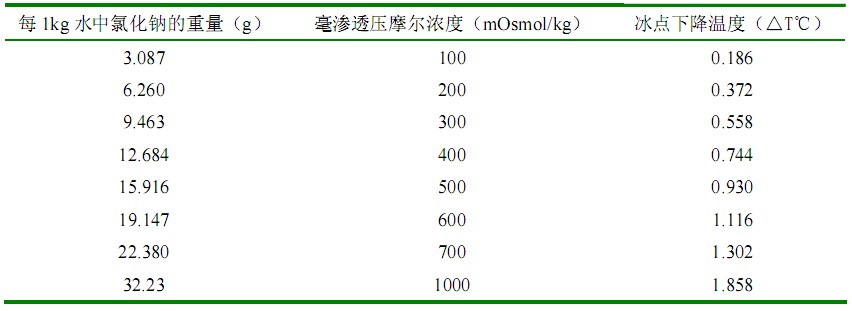
1.3 标准溶液 取基准氯化钠试剂,于 500~650℃干燥40~50 分钟,置干燥器(硅胶)中放冷至室温。根据需要,按表 1 所列数据精密称取适量,溶于1kg水中,摇匀。
表 1 渗透压摩尔浓度测定仪校正用标准溶液
1.4 供试品溶液 供试品如为液体,通常可直接测定;如为浓溶液,可用适宜的溶剂稀释至表 1 测定范围内;如为固体(如注射用无菌粉末),可采用药品标签或说明书中的规定溶剂溶解并稀释至表 1 测定范围内。需特别注意的是,溶液经稀释后,粒子间的相互作用与原溶液略有不同,一般不能简单的将稀释后溶液渗透压的测定值乘以稀释倍数来计算原溶液的渗透压摩尔浓度。例如,甘露醇注射液、氨基酸注射液等高渗溶液和注射用无菌粉末可用适宜的溶剂(如注射用水、5%葡萄糖溶液或生理盐水等)经溶解、稀释后测定,并在正文品种各论项下规定具体的溶解或稀释方法。
1.5 测定法 按仪器说明书操作,首先取适量新沸放冷的水调节仪器零点,然后由表 1 选择两种标准溶液(供试品溶液的渗透压摩尔浓度应介于两者之间)校正仪器,再测定供试品溶液的渗透压摩尔浓度或冰点下降的温度。
2 渗透压摩尔浓度比的测定 供试品溶液与 0.9%(g/ml)氯化钠标准溶液的渗透压摩尔浓度比率称为渗透压摩尔浓度比。用渗透压摩尔浓度测定仪分别测定供试品溶液与 0.9% (g/ml)氯化钠标准溶液的渗透压摩尔浓度OT与 O S ,方法同 1.5。并用下列公式计算渗透压摩尔浓度比:
渗透压摩尔浓度比=OT/OS
渗透压摩尔浓度比的测定用标准溶液的制备 精密称取经 500~650℃干燥40~50分钟并置干燥器(硅胶)中放冷的基准氯化钠 0.900g,加水使溶解并稀释至100ml,摇匀。